Nowe spojrzenie na wieloaspektową terapię celowaną w leczeniu glejaka wielopostaciowego

Opis projektu
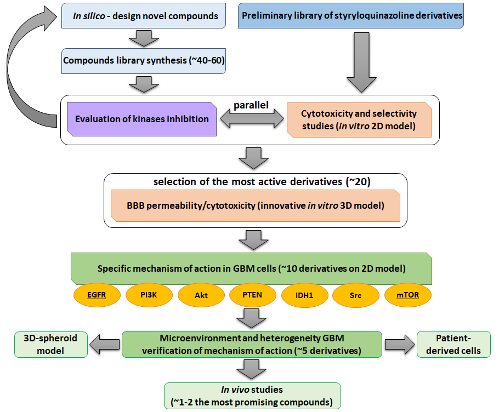
Badania realizowane w projekcie mają charakter interdyscyplinarny i obejmują trzy główne filary. Pierwszym z nich są analizy in silico koncentrujące się na projektowaniu leków, na podstawie których zostanie przeprowadzona synteza, a następnie na szeroko zakrojone badania biologiczne. Działania syntetyczne wykonywane są przez zespół Projektowania Leków i Nano-farmakologii, natomiast badania biologiczne prowadzone są w grupie Biofizyki Farmaceutycznej. Warto podkreślić, że nasze wcześniejsze doświadczenie i wstępne wyniki ukazujące potencjał pochodnych styrylchinazolin do działania w wieloaspektowym wymiarze, zainspirowały nas do opracowania nowych inhibitorów ukierunkowanych na szlak sygnałowy EGFR/mTOR. Warto podkreślić, że nasze założenie jest niezwykle nowatorskie i nie zostało dotychczas opisane w literaturze.
Ponadto, zaimplementowanie nowych terapii celowanych w GBM stanowi istotne wyzwanie ze względu na:
- agresywność kliniczną i ograniczoną skuteczność terapii.
GBM jest najczęstszym pierwotnym nowotworem mózgu o wyjątkowo agresywnym przebiegu i skrajnie niekorzystnym rokowaniu – mediana przeżycia pacjentów wynosi 12–15 miesięcy, a pięcioletnia przeżywalność pozostaje poniżej 5%. Pomimo stosowania złożonych strategii terapeutycznych, obejmujących maksymalną resekcję chirurgiczną, radioterapię oraz chemioterapię z użyciem temozolomidu, skuteczność leczenia pozostaje niewystarczająca. Co istotne, pomimo istnienia inhibitorów kinaz tyrozynowych celujących w receptor EGFR, żaden z nich nie uzyskał zatwierdzenia w leczeniu GBM. Ograniczeniem terapii systemowej jest również bariera krew-mózg (BBB), która uniemożliwia efektywne przenikanie większości leków do tkanki nowotworowej.
- wysoka heterogeniczność genetyczna i fenotypowa
GBM wykazuje niezwykle wysoki stopień heterogeniczności zarówno na poziomie komórkowym, jak i molekularnym. W obrębie jednego guza mogą współistnieć liczne aberracje chromosomalne oraz znaczne zróżnicowanie genetyczne, wynikające z niestabilności genomowej, co istotnie wpływa na odpowiedź na leczenie i adaptację nowotworu do pojedynczych terapii celowanych. Dodatkowym problemem, jest brak odpowiedniego modelu przedklinicznego w pełni oddającego złożoność glejaka.
- kluczowa rola szlaku sygnałowego EGFR/PI3K/AKT
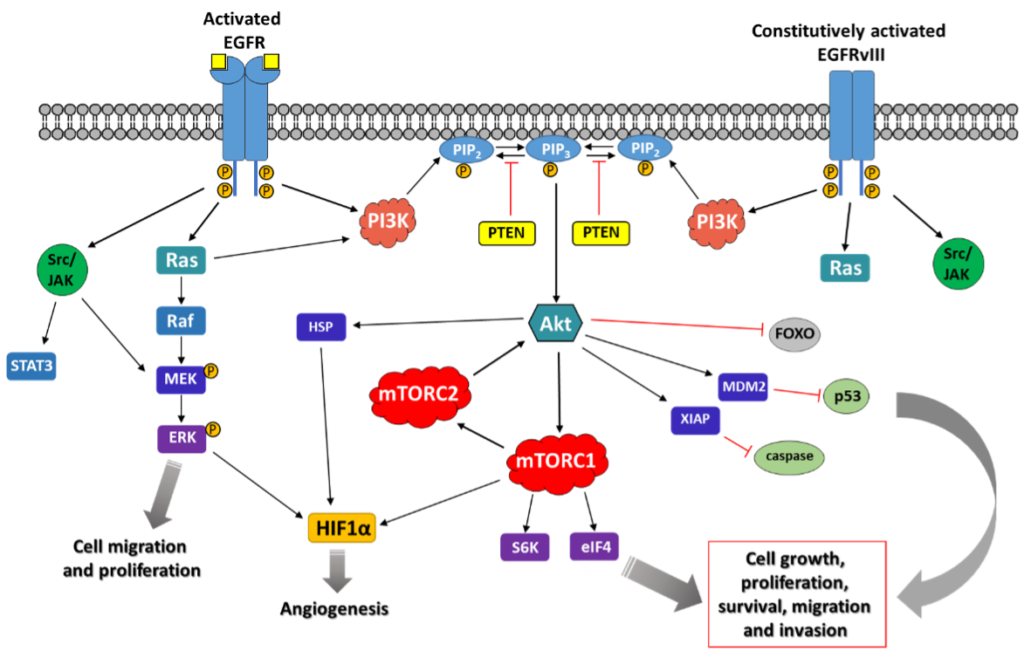
Wyniki analiz genomicznych jednoznacznie wskazują na istotną rolę szlaku RTK/PI3K/AKT w rozwoju GBM. Najczęściej występującą aberracją jest amplifikacja genu EGFR, prowadząca do nadekspresji białka EGFR, co obserwuje się w 40–60% przypadków. Zmiana ta, charakterystyczna głównie dla pierwotnego GBM, odgrywa kluczową rolę w inicjacji nowotworu oraz sprzyja jego progresji poprzez wzrost proliferacji, migracji, angiogenezy i zdolności inwazyjnych. Co istotne, nadekspresja EGFR koreluje z niższym wskaźnikiem przeżywalności pacjentów, co czyni ten receptor kluczowym celem dla nowych strategii terapeutycznych.
Ścieżka sygnałowa EGFR w glejaku wielopostaciowym:
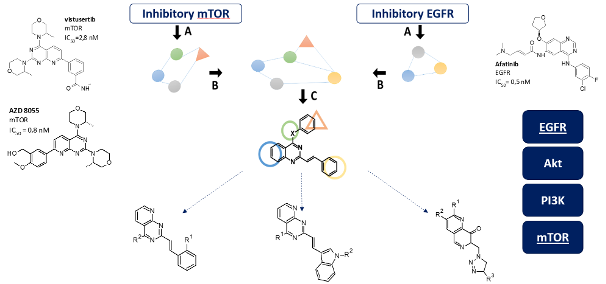
Projektowanie wielocelowych rusztowań i ich selekcja będzie obejmować obszerną analizę biblioteki ligandów mTOR i EGFR w celu ujawnienia wzajemnego farmakoforu dla wirtualnego podwójnego inhibitora. Konstrukt ten zostanie następnie wykorzystany do zaprojektowania nowych związków na rdzeniu 2-styrylochinazoliny. W rezultacie otrzymamy serię potencjalnych inhibitorów EGFR/mTOR z nowej klasy chemicznej. Synteza związków zostanie przeprowadzona przy użyciu standardowych protokołów i metod.
Uproszczony schemat analizy in silico:
Wszystkie zsyntetyzowane związki w ramach projektu zostaną przetestowane pod kątem ich aktywności przeciwnowotworowej i określone w odniesieniu do interakcji ze szlakiem sygnałowym EGFR. W związku z tym zostaną wykonane testy cytotoksyczności wobec panelu linii komórkowych GBM (U87-MG, U-251, DKMG/EGFRvIII, LN229, T98G), które mają zróżnicowaną ekspresję EGFR, PTEN, IDH1, mTOR z obecnością ich zmutowanych form. Ponadto przeprowadzone zostaną badania selektywności na komórkach prawidłowych astrocytów dla wszystkich aktywnych biologicznie pochodnych.
Równolegle do badań przeciwnowotworowych oceniony zostanie wpływ wszystkich zsyntetyzowanych związków na zdolność hamowania kinaz in vitro, m.in. tyrozynowych: EGFR, EGFRT790M, EGFRL858R, HER2, VEGFR, ABL, BTK, Src i Fyn, a także serynowo-treoninowych: Akt, mTOR i lipidowych: PI3KCA. Z uwagi na ich kluczową rolę w mediacji procesów biologicznych, jak progresja cyklu komórkowego, wzmaganie proliferacji, wzrostu oraz przeżycia komórek.
Istotnym elementem będzie określenie zdolności do przekraczania BBB dla najbardziej obiecujących inhibitorów, w kontekście osiągnięcia przez nich terapeutycznego stężenia w komórkach GBM. W razie niepowodzenia, planowane jest opracowanie nośników liposomowych i albuminowych, które efektywnie dostarczą lek do miejsca usytuowania guza.
Na komercyjnie dostępnych liniach komórkowych precyzyjnie zostanie określony mechanizm działania dla wybranych najbardziej obiecujących inhibitorów. Planujemy skupić się na wpływie inhibitorów na EGFR i jego dalsze cele (Akt, PI3K, mTOR), a także różne szlaki sygnałowe (RAS, MAPK, Src), wpływ na metabolizm komórkowy, cykl kwasu cytrynowego, indukcję stresu oksydacyjnego, zatrzymanie cyklu komórkowego i indukcję śmierci komórki poprzez apoptozę oraz autofagię.
Zwieńczeniem projektu będzie weryfikacja uzyskanych wyników na komórkach guza mózgu pochodzących od pacjentów. Ponadto, nasze inhibitory zostaną zweryfikowane na sferoidach 3D. Ze względu na heterogenność glejaków, przeprowadzimy badania na tych różnych modelach, które mogą lepiej odzwierciedlać mikrośrodowisko guza mózgu.
W końcowej fazie projektu określimy skuteczność terapii jednym lub dwoma najbardziej obiecującymi inhibitorami EGFR/mTOR (o niskiej toksyczności wobec komórek prawidłowych) na mysim modelu in vivo.
Schematyczny plan badawczy prezentuje się następująco: